Thérapie par cellules souches pour les blessures du tendon fléchisseur équin
Blessures SDFT chez les chevaux et la médecine régénérative
Les blessures au tendon fléchisseur numérique superficiel (SDFT) sont une origine importante de boiterie et d'athlétisme diminué dans l'industrie du sport équin, avec une prévalence décrite de 8 à 43% chez les chevaux de course pur-sang (Dowling, 2000). Cela est dû à la prévalence élevée de ces blessures, à la période de récupération prolongée et au taux élevé de récidive. Les blessures par SDFT sont à guérison lente, 20 à 60% des chevaux de course blessés retrouvant leur pleine capacité athlétique, mais jusqu'à 80% des chevaux de course blessés succombent à une nouvelle blessure (Dowling, 2000). Cette tendance à guérir lentement, et la construction d'une matrice extracellulaire mécaniquement moindre, est probablement due au fait que les tendons sont peu vascularisés, présentent des cellules avec une action mitotique réduite et ont peu de cellules progénitrices existant dans les tissus. Des recherches récentes sur les cellules souches mésenchymateuses (CSM) ont impliqué le développement potentiel de l'utilisation de la médecine régénérative comme nouveau traitement potentiel pour les blessures par SDFT.
Les blessures au tendon fléchisseur numérique superficiel (SDFT) sont une origine importante de boiterie et d'athlétisme diminué dans l'industrie sportive équine, avec une prévalence décrite de 8 à 43% chez les chevaux de course pur-sang.
Structure tendineuse chez un cheval
Les tendons sont principalement constitués d'eau (~ 70%); les 30% restants contiennent du collagène et une matrice sans collagène. Dans les tendons fléchisseurs normaux, le collagène de type I est le plus courant. Les types II, III, IV et V existent également, bien qu'en quantités moindres dans des positions plus particulières au sein du tendon. Le type II peut être situé dans des insertions osseuses et des zones où le tendon modifie les directions pour couvrir une projection osseuse, et est conçu pour résister à la compression et à la tension. Les types III, IV et V ne se trouvent que dans les membranes basales et l'endotendon. Les molécules de collagène sont organisées en microfibrilles, sous-fibrilles et fibrilles, et sont ensuite classées en fascicules qui sont vaguement divisés par des septa endoténons, et la matrice restante est constituée de ténocytes et de glycoprotéines. Les types de cellules I, II et III ont été reconnus dans les fascicules des tendons de cheval. L'allocation de ces cellules diffère avec l'âge et peut être principalement associée à la synthèse de la matrice extracellulaire. Plusieurs glycosaminoglycanes ont été trouvés dans les SDFT normaux, y compris le chondroïtinsulfate, le kératane sulfate, le dermatane sulfate, l'héparine, l'héparinsulfate et l'acide hyaluronique. La protéoglycane décécine, la fibromoduline et le biglycane sont présents dans le SDFT et influencent les fonctions des ténocytes, la fibrillogenèse du collagène et la disposition dimensionnelle des fibres. Cela influence la force du tendon. Les protéoglycanes peuvent également jouer un rôle dans la retenue des facteurs de croissance au sein de la matrice de collagène.
Les tendons sont principalement constitués d'eau (~ 70%); les 30% restants contiennent du collagène et une matrice sans collagène.
Lésions tendineuses courantes du cheval
Les lésions tendineuses d'origine naturelle sont décrites comme «des étirements, des glissements et des déchirures fibrillaires, suivis d'une fibrilolyse» qui est liée à la «libération d'enzymes des fibroblastes et des cellules inflammatoires endommagées» (Dowling, 2000). C'est là que le processus de guérison commence, suivi des phases sus-jacentes d'inflammation, de prolifération, de remodelage et de maturation. Le collagène de type III est le premier à être intégré au site de la blessure, formant les liaisons transversales interfibrillaires qui confèrent une résistance et une stabilité précoces au site de la blessure. Des quantités accrues de collagène de type IV et de type V se développent ensuite rapidement. Après ces phases aiguës, les fibres de collagène de type I deviennent les plus évidentes, et les fibrilles de collagène libres de type I et de type III apparaissent en quantités légèrement inférieures jusqu'à environ 6 mois après la blessure. Par la suite, les fibrilles de collagène de type I prédominent à nouveau, ce qui indique le remodelage et la normalisation continus du tissu cicatrisant. Des niveaux élevés anormaux de collagène de type III et une absence de tout assemblage rectiligne peuvent être présents jusqu'à quatorze mois après la blessure. Dans le tissu fibreux cicatriciel, la disposition et la composition anormales de la matrice, qui a une biomécanique encore plus médiocre par rapport au tissu tendineux moyen, et la diminution du taux de cicatrisation seraient à l'origine du taux élevé de re-blessures au SDFT. Pour plus d'informations sur les tendons équins et les blessures courantes des tendons (à l'exception des blessures à l'étouffement), je recommande de consulter Howell Equine Handbook of Tendon and Ligament Injuries.
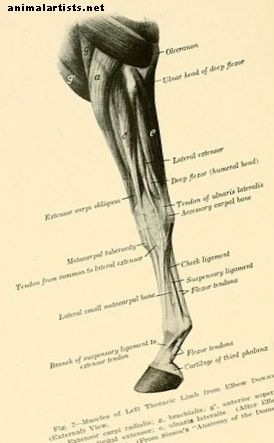
Les lésions tendineuses d'origine naturelle sont décrites comme des «étirements, glissements et déchirures fibrillaires, suivis d'une fibrilolyse» qui est liée à la «libération d'enzymes par les fibroblastes et les cellules inflammatoires endommagés».
Options thérapeutiques actuelles en médecine équine
Il existe plusieurs options actuellement acceptées pour traiter les blessures SDFT. Ces options de thérapie peuvent être classées en thérapies physiques, pharmacologiques et chirurgicales. Les thérapies physiques existent sous forme de givrage, d'hydrothérapie au froid, de bandage sous pression et de repos de décrochage, et ont été considérées comme la pierre angulaire dans les phases initiales du traitement des blessures SDFT afin de réduire l'inflammation et de réduire les risques de dommages supplémentaires. Les thérapies physiques sont souvent utilisées conjointement avec les thérapies médicamenteuses. Les schémas thérapeutiques comprennent généralement des anti-inflammatoires, du hyaluronate de sodium, des glycosaminoglycanes polysulfatés et du fumarate de bêta-aminoproprionitrile. Les options chirurgicales correctives comprennent actuellement la desmotomie ligamentaire accessoire, le fractionnement percutané du tendon, les implants tendineux synthétiques et la contre-irritation. D'autres options thérapeutiques moins étudiées comprennent les ultrasons thérapeutiques de faible intensité, la thérapie au laser infrarouge à basse fréquence et la thérapie par champ électromagnétique. Les résultats de ces traitements ont été variés, car il y a eu des données démontrables minimales que l'une des options de thérapie susmentionnées a eu des avantages fiables ou à long terme de manière cohérente. Cela est probablement dû en partie à la grande diversité des techniques et des préférences thérapeutiques parmi les vétérinaires et les propriétaires.
Les thérapies physiques existent sous forme de givrage, d'hydrothérapie au froid, de bandage sous pression et de repos de décrochage, et ont été considérées comme la pierre angulaire dans les phases initiales du traitement des blessures SDFT afin de réduire l'inflammation et de réduire les risques de dommages supplémentaires.
Thérapie par cellules souches mésenchymateuses (MSC) en médecine équine
Les cellules souches mésenchymateuses sont des cellules souches multipathiques non hématopoïétiques importantes pour une utilisation dans la thérapie des blessures orthopédiques chez les chevaux. Les cellules souches sont classées en cellules embryonnaires ou adultes, selon le niveau de développement de leur donneur. Aux fins de cette étude, l'accent sera mis ici sur les cellules adultes. Les cellules souches adultes constituent une population de cellules résidant normalement dans chaque type de tissu et aident à fournir une forme d'organe appropriée tout au long des processus de renouvellement cellulaire réguliers. Ces cellules souches ont également la capacité de se différencier en d'autres types de cellules d'origines tissulaires différentes selon les besoins, ce qui est appelé plasticité cellulaire. L'utilisation des CSM pour la régénération tissulaire a d'abord été encouragée sur la base de cette idée de la plasticité cellulaire; les tissus endommagés seraient directement stimulés par l'injection de CSM, les cellules peupleraient le site de la lésion, se différencieraient en le type de cellule approprié pour ce tissu et la régénération commencerait. Il a été découvert plus tard que ces cellules stimuleraient également la régénération indirectement en produisant des facteurs trophiques et immunomodulateurs bioactifs.
Le tissu adipeux et la moelle osseuse sont les deux sources les plus courantes de CSM utilisées en médecine équine, bien que des sources comme le sang périphérique et le sang du cordon ombilical gagnent en popularité, car elles sont moins invasives. Par rapport aux CSM humains, aucune norme de caractérisation n'est actuellement accessible pour les CSM d'origine animale. Par conséquent, diverses sociétés utilisent différentes méthodes pour caractériser les MSC animales, ce qui rend difficile la comparaison des résultats de recherche et des résultats cliniques des thérapies MSC utilisées chez les chevaux. Alors que les CSM des animaux peuvent être classés en fonction de leur capacité à adhérer au plastique et à se différencier, leur expression d'antigène de surface n'est toujours pas facilement identifiée. Cette disponibilité limitée d'anticorps spécifiques en médecine vétérinaire limite les possibilités d'un véritable immunophénotypage des CSM.
Résultats des études MSC en cours
En 2003, l'utilisation des CSM à des fins de traitement des lésions des tendons équins a été définie pour la première fois, avec seulement cinq articles de recherche sur le sujet publiés (Van de Walle, 2016). Après cet événement, l'utilisation des CSM en médecine régénérative équine est montée en flèche, des milliers d'équidés étant désormais traités avec cette méthode. Cependant, l'efficacité des thérapies MSC équine est encore quelque peu incertaine, car les groupes témoins appropriés ne sont pas toujours utilisés et d'autres facteurs biologiques sont souvent utilisés en conjonction avec des cellules souches. Pourtant, des recherches antérieures ont démontré une relation positive entre la thérapie par cellules souches mésenchymateuses et la régénération saine des tendons dans les traumatismes SDFT, certains démontrant une diminution des taux de récidive (Badial, 2013; Carvalho, 2011; Godwin, 2013; Guercio, 2015; Smith, 2003).
Une étude de 2013 en particulier a utilisé des méthodes similaires à celles de cette étude. Dans cette étude précédente, les lésions ont été induites en utilisant une injection de gel de collagénase dans la région métacarpienne des SDFT de huit chevaux de races mixtes. Les chevaux du groupe de traitement ont été traités par une injection interlesionnelle de cellules souches mésenchymateuses dérivées de tissu adipeux en suspension dans le concentré de plaquettes. Après 16 semaines de traitement, des biopsies ont été réalisées pour des analyses histopathologiques, immunohistochimiques et d'expression génique. Les résultats de cette étude ont démontré que l'utilisation de cellules souches mésenchymateuses et de concentré de plaquettes empêchait la progression des lésions tendineuses, entraînait une meilleure disposition des cellules et diminuait l'inflammation par rapport au groupe témoin. (Badial, 2013)
Une étude réalisée en 2014 sur neuf chevaux présentant des blessures SDFT préexistantes a noté des preuves de processus tissulaires réparateurs post-traitement après avoir utilisé des cellules souches mésenchymateuses dérivées de l'adipose comme méthode de traitement (Guercio, 2014). Une étude de deux ans en 2012 sur 141 chevaux de course appartenant à des clients avec des blessures préexistantes a utilisé des cellules souches dérivées de la moelle osseuse plutôt que des cellules dérivées de l'adipose, mais n'a observé aucun effet indésirable du traitement; cependant, une diminution significative des taux de re-blessures chez les chevaux de course a été observée (Godwin, 2012).
Bien que ces études précédentes aient toutes tenté d'observer une relation entre les lésions SDFT et les cellules souches mésenchymateuses, il existe de nombreux facteurs de confusion et de nombreuses lacunes évidentes dans cette recherche. Certaines études n'ont pas réussi à utiliser une quantité suffisante de sujets pour fournir des preuves concluantes, d'autres ont utilisé un large éventail de races, d'âges, de sexes et de disciplines sportives. D'autres utilisent un nombre variable de cellules souches et des intervalles de traitement. Le facteur de confusion peut-être le plus important est que la plupart de ces études ont utilisé des chevaux avec des blessures préexistantes, créant une grande variation dans la taille, la gravité, la durée des blessures, etc., et n'ont pas réussi à déterminer si ces facteurs avaient une relation avec les résultats. En utilisant un plus grand groupe de chevaux d'âge, de sexe, de race et de discipline restreinte, un nombre prédéfini de cellules souches, une blessure spécifique, un plan de traitement et un intervalle de traitement, et en s'efforçant d'établir des relations entre ces facteurs et les résultats, de nouvelles études devraient s'efforcer de réduire les facteurs de confusion et d'acquérir des preuves plus concluantes. À partir de ce moment, des recherches supplémentaires sont nécessaires pour étudier les effets de la thérapie par cellules souches chez les équidés.
SDFT Quiz sur les blessures et les MSC
afficher les statistiques du quizLes références
Badial, P., Deffune, E., Borges, A., Carvalho, A., Yamada, A., Álvarez, L., Garcia Alves, A. (2013). Thérapie contre la tendinite équine utilisant des cellules souches mésenchymateuses et des concentrés de plaquettes: un essai contrôlé randomisé. Recherche et thérapie sur les cellules souches, 4 (4), 1-13. doi: 10.1186 / scrt236
Crovace, A., Lacitignola, L., Rossi, G., Francioso, E. (2009). Évaluation histologique et immunohistochimique des cellules souches mésenchymateuses de moelle osseuse en culture autologue et des cellules mononucléées de la moelle osseuse dans la tendinite induite par la collagénase du tendon fléchisseur numérique superficiel équin. Veterinary Medicine International, 2010, 1-10. doi: 10.4061 / 2010/25097
Dowling, BA, Dart, AJ, Hodgson, DR et Smith, RKW (2000), Tendinite fléchissante numérique superficielle chez le cheval. Equine Veterinary Journal, 32: 369–378. doi: 10.2746 / 042516400777591138
Godwin, EE, Young, NJ, Dudhia, J., Beamish, IC et Smith, RKW (2012). L'implantation de cellules souches mésenchymateuses dérivées de la moelle osseuse démontre une amélioration des résultats chez les chevaux présentant une lésion excessive du tendon fléchisseur numérique superficiel. Equine Veterinary Journal, 44 (1): 25–32. doi: 10.1111 / j.2042-3306.2011.00363.x
Guercio, A., Di Marco, P., Casella, S., Russotto, L., Puglisi, F., Majolino, C., Piccione, G. (2015). Cellules souches mésenchymateuses dérivées de graisses sous-cutanées et de plasma riche en plaquettes utilisées chez les chevaux de sport avec boiterie du tendon fléchisseur numérique superficiel. Journal Of Equine Veterinary Science, 35 (1), 19-26. doi: 10.1016 / j.jevs.2014.10.006
Richardson LE, Dudhia J., Clegg PD, Smith, R. (2007). Cellules souches en médecine vétérinaire - tentatives de régénération du tendon équin après une blessure. Trends in Biotechnology, 25 (9), 409-16.
Van de Walle, G., De Schauwer, C., Fortier, L. (2016). Thérapie par cellules souches mésenchymateuses. Equine Clinical Immunology (1 er éd.) John Wiley & Sons, Inc. Extrait de https://lmunet.illiad.oclc.org/illiad/TNF/illiad.dll?Action=10&Form=75&Value=25484